DETERMINAÇÃO DO NÚMERO DE AVOGADRO-CRISTALOGRAFIA DE RAIOS-X
A cristalografia de raios X permite determinar a estrutura tridimensional de cristais com grande precisão. A partir desses dados, é possível calcular o número de Avogadro, conectando massa molar, volume da célula unitária e densidade.
A cristalografia de raios X permite determinar, com grande precisão, a estrutura tridimensional de cristais — incluindo:
- a geometria do retículo cristalino (isto é, o arranjo periódico das partículas no espaço);
- a distância entre átomos e suas posições relativas;
- o volume da célula unitária, que é a menor unidade repetitiva do cristal.
A partir dessas informações, é possível fazer um cálculo indireto de 𝑁ₐ, conectando grandezas macroscópicas (como a massa molar) com grandezas microscópicas (como o volume de uma célula unitária).
Passo a passo do cálculo de 𝑁ₐ via cristalografia de raios X
Vamos organizar esse cálculo em etapas lógicas. Suponha que vamos fazer isso com o cloreto de sódio (NaCl), um cristal iônico bastante estudado:
- Determinar o volume da célula unitária (𝑉ₐ)
Por meio da difração de raios X, identifica-se a estrutura cúbica de face centrada (CFC) do NaCl. Com isso, é possível calcular o parâmetro de rede (a), ou seja, o comprimento da aresta do cubo.
Por exemplo:
Se a = 564 pm (picômetros) = 5,64 × 10⁻⁸ cm
Então, o volume da célula unitária (𝑉ₐ) é:
Va=a3=(5,64×10−8 cm)3=1,79×10−22 cm3
- Descobrir quantas unidades formais de fórmula existem por célula unitária (𝑍)
Na estrutura CFC do NaCl, há 4 unidades fórmula de NaCl por célula unitária, ou seja:
Z=4
- Calcular a massa de uma célula unitária (𝑚ₐ)
4. Usar a densidade (𝜌) para relacionar massa e volume
5.Substituir os valores experimentais
Vamos colocar os valores
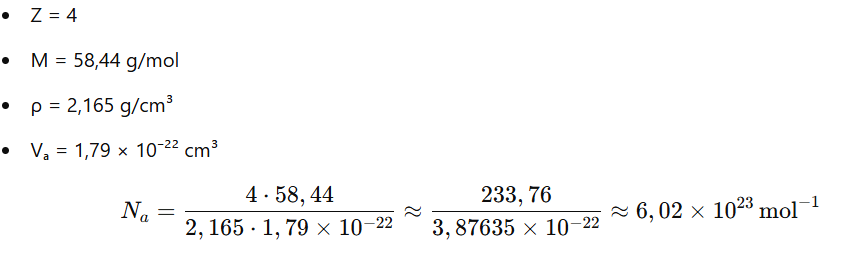
Por que essa técnica é tão importante?
- Porque liga o mundo microscópico ao macroscópico.
- Porque permite o cálculo de 𝑁ₐ sem precisar contar átomos — algo fisicamente impossível.
- Porque fornece altíssima precisão usando cristais perfeitos e técnicas de difração avançadas.
Outras substâncias que podem ser usadas
Além do NaCl, esse cálculo também pode ser feito com:
- Silício (estrutura covalente)
- Alumínio (estrutura metálica)
- Diamante (covalente, tetraédrica)
Desde que:
- A substância forme cristais bem definidos;
- A densidade seja conhecida;
- A massa molar seja determinada com precisão;
- A célula unitária possa ser identificada.
Curiosidade histórica
Foi por meio de métodos similares que, no início do século XX, cientistas como William Henry Bragg e seu filho Lawrence Bragg (ganhadores do Nobel em 1915) conseguiram desvendar estruturas cristalinas, o que abriu o caminho para a determinação moderna do número de Avogadro com alta precisão.


