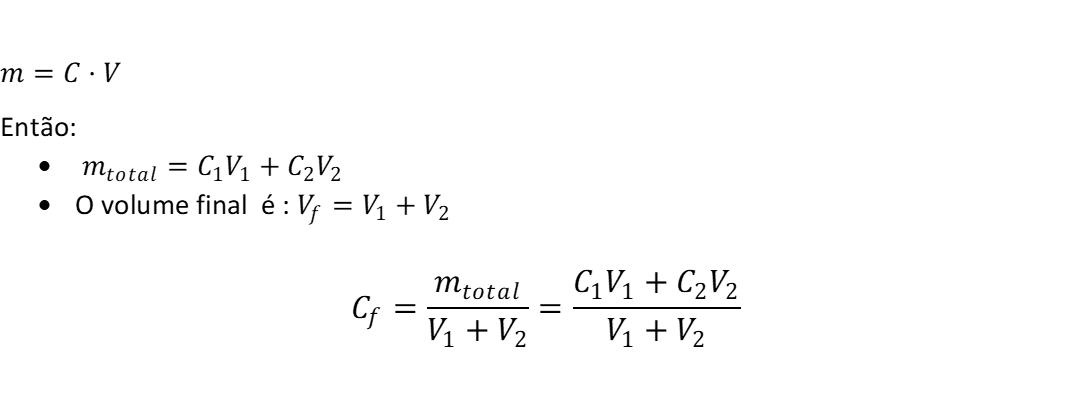EP-115-QB-75-MISTURA SEM PEGADINHA: COMO CALCULAR A CONCENTRAÇÃO FINAL
Esse é o episódio 115: “Mistura sem pegadinha — como calcular a concentração final”.
Obrigado por seguir com a gente nessa jornada de aprendizado, que é pra todo mundo: sem mistério, sem pegadinha.
Bora destravar mistura de soluções com e sem adição de solvente?
Começando do começo: o que é “mistura de soluções”?
Mistura de soluções é quando você pega duas ou mais soluções e junta no mesmo recipiente. Se o soluto é o mesmo (por exemplo, NaCl em água + NaCl em água), você pode calcular uma concentração final única para a solução resultante.
E se o soluto for diferente? Tipo açúcar em água misturado com sal em água?
Aí não existe “uma concentração final do soluto” como se fosse a mesma coisa. Você calcula a concentração do açúcar separadamente e a do sal separadamente. Hoje o foco é: mesmo soluto.
E o ponto-chave que resolve tudo?
Na mistura, o que se conserva é a quantidade de soluto.
· Se concentração for em mol/L (molaridade): a quantidade conservada é o número de mols
· Se concentração for em g/L: a quantidade conservada é a massa do soluto
O que não se conserva é a concentração, porque o volume muda.
Tradução do universo: você não “conserva o tempero por litro”, você conserva o tempero total que colocou. Depois divide pelo volume final.
Resumo-relâmpago:
· Mistura do mesmo soluto: soma o soluto total (mols ou gramas).
· Volume final é a soma dos volumes
· Concentração final = (soluto total) / (volume final).
E não, não é média simples.
Dedução da fórmula: mistura de 2 soluções :Caso 1: concentração em mol/L (molaridade)
Vamos deduzir sem decorar?

Olha o que aconteceu: virou uma “média ponderada” pelo volume. Se os volumes forem iguais, aí sim parece “média”, mas não é regra.
Vamos agora considerar a concentração em g/L
Se a concentração estiver em g/L, o raciocínio é o mesmo, só troca “mols” por “massa”:
Mesma cara de fórmula, mas o significado muda: antes era mol/L, agora é g/L.
Generalizando par N Soluções

Isso é literalmente “mistura e depois dilui”: o soluto total não muda com o solvente, só o volume aumenta.
Exemplos numéricos
Vamos ao exemplo 1
Misturamos 200 mL de solução de NaCl 1,5 mol/L com 300 mL de solução de NaCl 0,5 mol/L. Qual a molaridade da solução resultante?

Vamos ao exemplo 2, agora em g/L
Misture 100 mL de solução de glicose 40 g/L com 400 mL de solução de glicose 10 g/L. Qual a concentração na mistura final?

Olha que bonito: deu 16 g/L, bem mais perto de 10 do que de 40, porque o volume de 10 g/L é muito maior.
Vamos ao exemplo 3, envolvendo mistura + adição de solvente
Misturei 100 mL de solução de HCl 2,0 mol/L com 100 mL de solução de HCl 1,0 mol/L e depois adicionei 200 mL de água. Qual a concentração final?

Erros mais comuns
- Fazer média simples das concentrações ignorando os volumes.
- Esquecer de converter mL → L (ou misturar unidades).
- Aplicar a fórmula quando os solutos são diferentes.
- Esquecer de somar o volume do solvente adicionado no caso de diluição após mistura.
- Não fazer checagem: resultado final deve ser coerente (normalmente entre as concentrações misturadas, quando não há solvente adicionado e todas são do mesmo soluto).

Desafio do ouvinte: pause e tente.
Misturam-se 80 mL de uma solução de KCl 2,5 g/L com 120 mL de outra solução de KCl 1,0 g/L. Em seguida, adicionam-se 200 mL de água. Determine a concentração final em g/L.
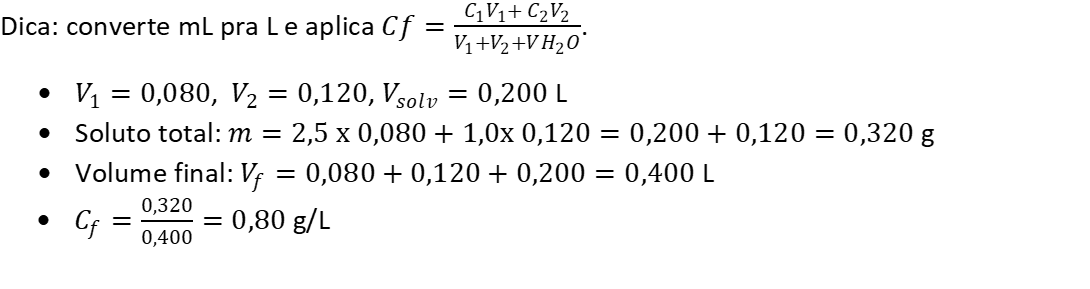
·
E aí, conseguiu acompanhar direitinho? Mistura agora é um conceito sem mistério!
Se ficou com dúvida, volta, pausa, escuta com calma — e manda sua pergunta pra gente nas redes! A gente adora conversar com vocês.
E se curtiu esse episódio, compartilha com quem também precisa descomplicar a Química. Segue o podcast no seu tocador favorito e ativa o sininho, porque tem muita coisa boa vindo por aí em 2026
Até a próxima! E lembre-se: aprender pode (e deve) ser leve.
Mande suas dúvidas, sugestões e conteúdo que você gostaria de ouvir no Papo de Química para o nosso e-mail: podcast@papodequimica.com
Acompanhe também nas redes sociais: @papodequimica_
Visite nosso site: www.papodequimica.com