TEXTO DO EP-107-QB-70-O CÓDIGO DOS GASES: DECIFRANDO LEIS E TRANSFORMAÇÕES
Sejam todos muito bem-vindos a mais um episódio do Papo de Química e hoje vamos mergulhar no fascinante universo dos gases. Apesar de invisíveis, os gases estão em tudo que a gente faz, desde respirar até acender uma chama no fogão. Vem com a gente porque hoje vamos decifrar o código dos gases, entendendo como pressão, volume, temperatura e quantidade de matéria moldam o nosso mundo. Vamos começar pelo básico: as variáveis de estado. São elas que descrevem um gás: pressão (P), volume (V), temperatura (T) e quantidade de matéria (n). Pensa assim: é como se fosse a “ficha de identidade” do gás. Se eu sei essas quatro variáveis, consigo prever o comportamento dele. Exemplo prático: o ar dentro de um pneu. Ele tem um volume fixo, mas a pressão muda quando a temperatura aumenta, como num dia quente.
Quando uma dessas variáveis permanece constante e as outras mudam, temos as transformações gasosas. Existem três tipos principais: isotérmica (T constante), isobárica (P constante) e isocórica ou isovolumétrica (V constante). E claro, existe a equação geral dos gases, que une todas elas num só modelo.
Na transformação isotérmica, a temperatura do gás permanece constante durante todo o processo. Quando falamos de um gás ideal, isso significa que a pressão e o volume estão ligados de forma inversa:
Se o volume diminui, a pressão aumenta.
Se o volume aumenta, a pressão diminui.
Essa relação é descrita pela conhecida Lei de Boyle-Mariotte.
Imagine uma seringa (sem agulha).Se você empurra o êmbolo, o espaço interno diminui- o volume do ar fica menor. O que acontece? Você sente resistência ! Isso é a pressão aumentando. Agora, se você puxa o êmbolo, o volume aumenta e a pressão diminui, ficando mais fácil de puxar. Essa é uma demonstração prática da relação entre pressão e volume numa transformação isotérmica.
Matematicamente, isso se expressa assim : P ∝ 1/V , ou seja, P × V = constante
Isso quer dizer que, em qualquer ponto do processo, o produto entre pressão e volume será sempre o mesmo. Comparando dois momentos diferentes, usamos a fórmula:
P₁ × V₁ = P₂ × V₂
Onde:
- P₁ e V₁ são a pressão e o volume no início.
- P₂ e V₂ são a pressão e o volume em outro momento qualquer.
Se colocarmos isso num gráfico de pressão (P) no eixo vertical e volume (V) no eixo horizontal, veremos uma hipérbole- uma curva que mostra a relação inversa entre as grandezas.
Vamos a um exemplo: Um gás ocupa 4 L a 2 atm de pressão. Qual será o volume se a pressão cair para 1 atm?
Aplicando a Lei de Boyle : P1V1 = P2V2 \ 2 atm x 4L = 1 atm x V2 ⇒V2 = 8 L
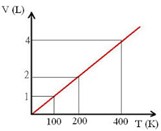
Na transformação isobárica o volume e temperatura mudam, mas a pressão se mantem constante. Essa é a Lei de Charles e Gay-Lussac. Ela diz que o volume é diretamente proporcional à temperatura absoluta (medida em Kelvin).
- Se a temperatura aumenta, o volume também aumenta.
- Se a temperatura diminui, o volume se reduz.
A relação entre volume e temperatura pode ser representada por:
V ∝ T ⇒ =constante
Quando comparamos dois estados diferentes: V1/T1 =V2/T2
O gráfico V × T é uma reta crescente que passa pela origem.
Por que balões de gás incham ao sol? Porque o ar interno aquece em seu interior aquece. Com a temperatura mais alta, o volume aumenta. Um exemplo direto da Lei de Charles em ação!
Vamos a um problema: Um gás ocupa um volume de 2,0 L a 27 °C. Qual será o novo volume quando a temperatura for elevada para 327 °C, mantendo-se a pressão constante?
Dados:
- Volume inicial (V₁): 2,0 L
- Temperatura inicial (T₁): 27 °C = 27 + 273 = 300 K
- Temperatura final (T₂): 327 °C = 327 + 273 = 600 K
- Volume final (V₂): ?
Aplicando a V1/T1 = V2/T2 \ Substituindo os valores: 2/300 = V2/600
Resolver com regra de três ou Multiplicação cruzada: V2= 4L
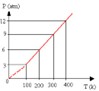
Na transformação isocórica (ou isovolumétrica), o volume não muda. O que varia com a temperatura é a pressão. Pela Lei de Gay-Lussac, a pressão é diretamente proporcional à temperatura absoluta (em Kelvin). Isso significa que, quando a temperatura do gás aumenta, sua pressão também aumenta na mesma proporção, e quando a temperatura diminui, a pressão se reduz.
Matematicamente : P ∝ T ⇒ = constante
onde K é uma constante característica para a massa fixa de gás mantida em volume constante.
Quando comparamos dois estados diferentes: P1/T1=P2/T2
O gráfico P × T: também é uma reta crescente passando pela origem
Exemplo: uma lata de spray deixada no sol. A temperatura sobe, a pressão interna aumenta, e pode causar uma explosão.
Um gás ideal está contido em um recipiente rígido (volume constante). Inicialmente, encontra-se a P1=2,0 atm e T1=300 K. O sistema é aquecido até T2 = 450 K, sem variação de volume e de quantidade de matéria. Determine a pressão final P2 do gás.
Dados: P1=2,0 atm ; T1=300 K ; T2=450 K , P2=?
Aplicando a Lei de Gay-Lussac : P1/T1 = P2/T2
Substituindo os valores: 2/300 = P2/450
Resolver com regra de três ou Multiplicação cruzada: P2 = 3 atm
Quando pressão (P), volume (V) e temperatura (T) mudam ao mesmo tempo, usamos, usamos a equação geral dos gases : P1xV1/T1 = P2xV2/T2
- P1,V1,T1: valores iniciais de pressão, volume e temperatura
- P2,V2,T2: valores finais após a mudança de estado
- n (número de mols) permanece constante
- T deve estar em Kelvin
Um gás ocupa 5 L sob pressão de 2 atm e temperatura de 300 K.
Qual será o volume ocupado por esse gás se a pressão for reduzida para 1 atm e a temperatura aumentada para 600 K?
Dados do problema
- P1=2 atm
- V1=5 L
- T1=300 K
- P2=1 atm
- T2=600 K
- V2=?
Como a quantidade de matéria (n) é constante, usamos: P1.V1/T1 = P2.V2/T2
Substituindo os valores: 2x5/300 = 1xV2/400 V2= 20L
Hoje vimos como leis formuladas há séculos ainda explicam fenômenos do nosso dia-a-dia- dos pneus ao clima, dos balões a indústria. E aprendemos que os gases seguem padrões previsíveis e calculáveis. A Ciência está em toda parte!