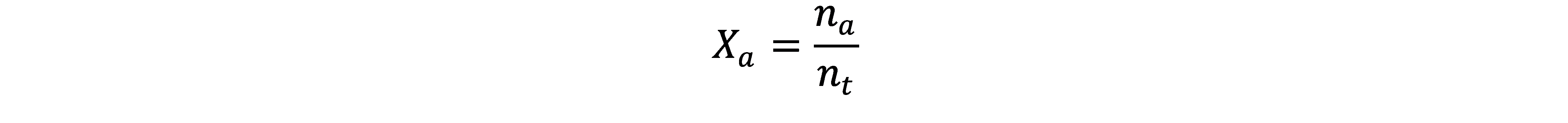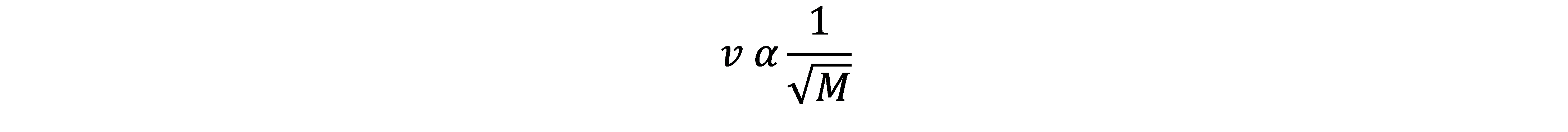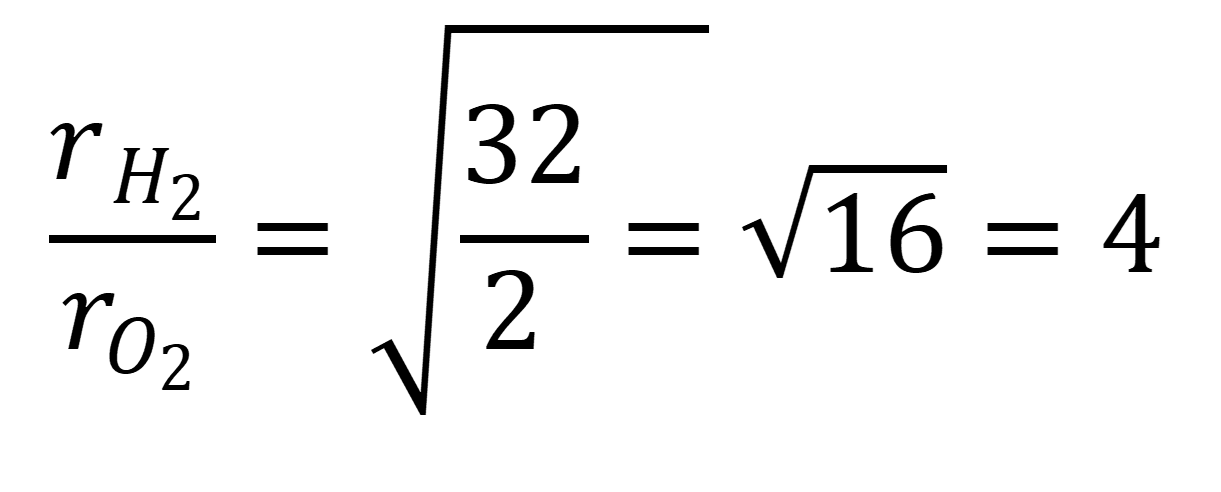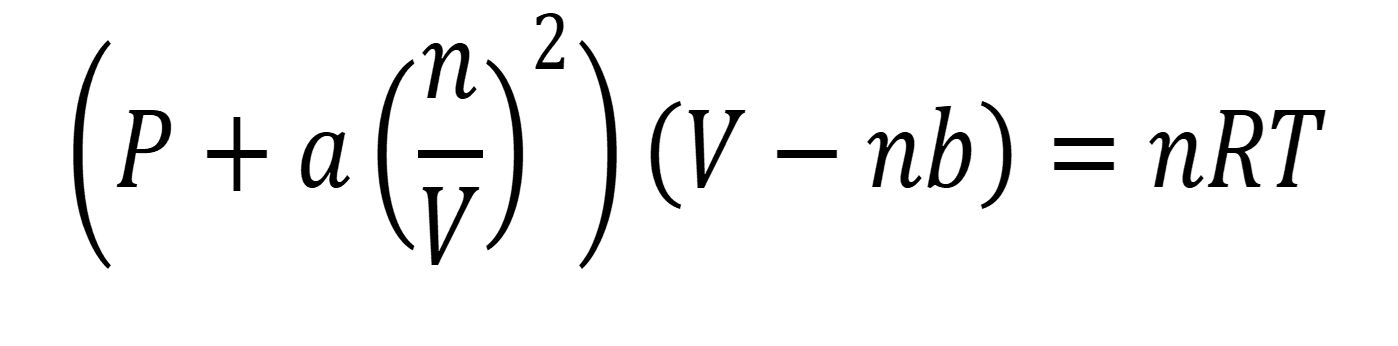TEXTO-EP-108-“GASES EM AÇÃO : O SHOW DAS MOLÉCULAS”
Esse é o terceiro episódio da nossa série sobre o estudo dos gases! Se você ainda não ouviu os episódios 106 e 107, corre lá na sua plataforma favorita de áudio. e escuta — eles são essenciais pra entender essa jornada gasosa do começo ao fim! Vamos começar com uma recapitulação rapidinha. Quando a gente mantém a quantidade de matéria constante, aquela letrinha "n", e varia pressão, volume e temperatura, a gente usa a equação:
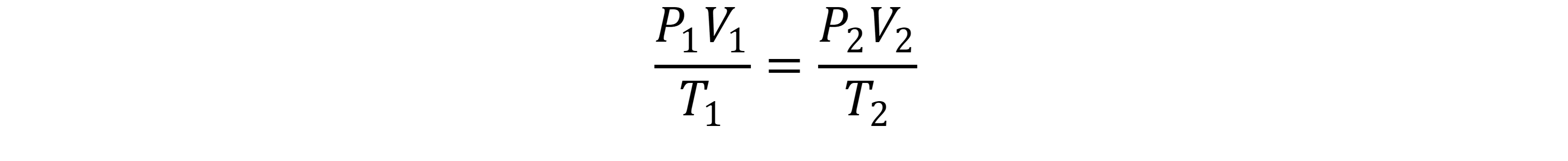
A equação é simples e poderosa: PV = nRT , Onde: P é pressão (em atm), V é volume (em litros), n é o número de mols, T é a temperatura (em Kelvin), e R é a constante universal dos gases. Aliás, R pode ter diferentes valores dependendo da unidade usada, mas no geral a gente usa: R = 0,082 atm·L·mol⁻¹·K⁻¹
Vamos pra um exemplo prático! Imagina que você tem 5,0 L de gás oxigênio, a 300 K e sob pressão de 2,5 atm. Quanto isso dá em mols e em massa?
A partir da equação de Clapeyron, usamos a equação: n = PV / RT, substituindo os valores n = (2,5 × 5,0) / (0,082 × 300) = 0,508 mol
E como a massa molar do oxigênio(O₂) é 32 g/mol, a massa será: m = n × M = 0,508 × 32 = 16,3 g
Falando em mols, você sabia que 1 mol de gás ideal ocupa 22,4 litros em CNTP?
Sim! CNTP é o padrão que usamos aqui no Brasil — 0 °C e 1 atm. Já as condições de Pressão e Temperatura padrão(STP), usado pela IUPAC, considera 1 bar de pressão.
E por isso, em STP, o volume molar ideal é 22,7 L/mol. Quase igual, mas com aquela diferença nerd que a gente ama!
Você sabia que dá pra calcular a densidade de um gás a partir da equação de Clapeyron?
Tudo começa com a equação: PV = nRT , agora, lembrando que o número de mols (n) pode ser escrito como a razão entre a massa (m) e a massa molar (M), ou seja: n = m/M
Substituindo isso na equação de Clapeyron, temos: PV = (m/M)RT
Reorganizando a equação, podemos isolar a densidade. Como densidade é massa por volume, ou seja, d = m/V, chegamos à expressão:
d = PM / RT
Essa fórmula nos mostra que a densidade de um gás depende da pressão (P), da massa molar (M), da temperatura (T) e da constante dos gases (R). Uma forma prática e poderosa de entender o comportamento dos gases em diferentes condições!
Vamos a um exemplo prático? Qual é a densidade do gás oxigênio (O₂) sob pressão de 1,10 atm e temperatura de 35 °C?
Passo 1: Converter a temperatura para Kelvin
Lembrando que a temperatura na equação dos gases deve estar em Kelvin:
T = 35 + 273 = 308 K
Passo 2: Aplicar a fórmula da densidade
A equação é: d = (P × M) / (R × T)
Onde:
- P = 1,10 atm
- M = 32 g/mol (massa molar do O₂)
- R = 0,082 atm·L/mol·K
- T = 308 K
Substituindo os valores: d = (1,10 × 32) / (0,082 × 308)
d ≈ 35,2 / 25,26
d ≈ 1,39 g/L
E dá pra fazer o caminho inverso também! Se souber a densidade, a pressão e a temperatura, dá pra calcular a massa molar do gás.
A Lei de Avogadro é linda: mesmo volume, mesma temperatura e mesma pressão → mesmo número de partículas, não importa o gás!
Isso mesmo! Por isso, 1 L de H₂ tem o mesmo número de moléculas que 1 L de O₂ em CNTP:
6,02 × 10²³ moléculas!
E se dobrar o número de mols, dobra o volume também! A equação é: V₁/n₁ = V₂/n₂
Agora vamos de Lei de Dalton! Em uma mistura de gases, a pressão total é a soma das pressões parciais:
Ptotal = P₁ + P₂ + ...Pn
Quer um exemplo? Aqui vai:
Temos uma mistura gasosa formada por dois gases:
- Oxigênio (O₂) a 0,8 atm
- Nitrogênio (N₂) a 0,2 atm
Qual é a pressão total da mistura?
Segundo a Lei de Dalton, a pressão total de uma mistura gasosa é a soma das pressões parciais de cada gás presente. Em outras palavras:
Ptotal = PO₂ + PN₂
Substituindo os valores: Ptotal = 0,8 atm + 0,2 atm =igma( 1,0 atm
E dá pra calcular a pressão parcial com fração molar também: , lembrando que
Temos um frasco com volume V e temperatura T constantes. No seu interior, há uma mistura gasosa com:
- 0,60 mol de N₂
- 0,40 mol de O₂
- Pressão total da mistura: 1,20 atm
Queremos calcular: As pressões parciais do N₂ e do O₂.
Passo 1: Calcular a fração molar de cada gás
A fórmula da fração molar (X) é: Xₐ = nₐ / ntotal
- ntotal = 0,60 + 0,40 = 1,00 mol
- XN₂ = 0,60 / 1,00 = 0,60
- XO₂ = 0,40 / 1,00 = 0,40
Passo 2: Aplicar a fórmula da pressão parcial
A fórmula é: Pₐ = P_total × Xₐ
- PN₂ = 1,20 atm × 0,60 = 0,72 atm
- PO₂ = 1,20 atm × 0,40 = 0,48 atm
Resultado final:
Pressão parcial do N₂: 0,72 atm
Pressão parcial do O₂: 0,48 atm
E, claro: 0,72 + 0,48 = 1,20 atm → Confirmando a pressão total!
A Lei de Amagat afirma que, para uma mistura gasosa nas mesmas temperatura (T) e pressão (P), o volume total é igual à soma dos volumes parciais que cada componente ocuparia se estivesse isolado nas mesmas condições.
Quando a Lei é Válida?
- Exata para misturas ideais, sob baixa pressão e comportamento ideal.
- Aproximação para gases reais — pode falhar em pressões elevadas ou quando há fortes interações entre moléculas.
Quer um exemplo? Aqui vai:
Considere 40 L de uma mistura formada por 1mol de CO2 e 3 mols de N2 , em condições fixas de T e P. Calcule o volume de cada gás
1) Vamos calcular a fração molar de cada gás
- XCO2=1/1+3 = ¼ = 0,25
- XN2=3/4 = 0,75
2) Cálculo do volume de cada gás
VCO2 = 40 × 1/4=10 L
VN2 = 40 × 3/4=30 L
A Lei de Graham estabelece que a velocidade de difusão ou efusão de um gás é inversamente proporcional à raiz quadrada de sua massa molar.
Em outras palavras:
Gases mais leves (com menor massa molar) se difundem ou efundem mais rapidamente do que gases mais pesados, quando estão sob as mesmas condições de temperatura e pressão.
- Forma matemática (para dois gases 1 e 2):
onde r é a taxa de difusão/efusão e M é a massa molar.
Vamos comparar as velocidades de efusão do hidrogênio (H₂) e do oxigênio (O₂).
- Massa molar de H₂ ≈ 2 g/mol
- Massa molar de O₂ ≈ 32 g/mol
Aplicando a Lei de Graham:
Logo, o hidrogênio difunde/eflui cerca de 4 vezes mais rápido que o oxigênio.
Claro que nem tudo são flores. O modelo de gás ideal funciona bem em baixas pressões e altas temperaturas...
Mas começa a falhar quando as moléculas se aproximam demais — surgem interações, e o volume delas não pode ser ignorado.
Aí entra a equação de van der Waals, com correções para pressão (a) e volume (b):
Quando a = 0 e b = 0, ela vira o nosso velho conhecido PV = nRT. Mas quando as condições apertam, ela mostra como os gases se comportam de verdade.
Ufa! Hoje foi gás do começo ao fim! Mas olha quanto conteúdo incrível a gente viu!
De Clapeyron a Graham, passando por densidade, volume molar, leis de mistura... um verdadeiro show das moléculas!
E semana que vem tem mais! Então já segue a gente no seu tocador favorito e compartilha com aquele amigo que vive dizendo: “Ah, química é difícil…” — manda esse episódio pra ele!
Até a próxima!